Definizione
 La Miastenia Gravis è una malattia autoimmune della parte post-sinaptica della giunzione neuromuscolare la cui patogenesi consiste in un attacco anticorpo-mediato Al Recettore dell’acetilcolina sito sulla membrana post-sinaptica della giunzione neuromuscolare.
La Miastenia Gravis è una malattia autoimmune della parte post-sinaptica della giunzione neuromuscolare la cui patogenesi consiste in un attacco anticorpo-mediato Al Recettore dell’acetilcolina sito sulla membrana post-sinaptica della giunzione neuromuscolare.
Caratteristiche cliniche
La Miastenia Gravis ha come caratteristica principale l’ipostenia fluttuante di alcuni muscoli volontari, in particolare di quelli innervati dai nuclei motori del tronco encefalico; un’altra caratteristica distintiva è l’esauribilità muscolare, il rapido recupero con il riposo e la risposta ai farmaci anticolinesterasici.
Note storiche
Secondo numerose fonti storiche fu Willis nel 1672 a descrivere per primo questa entità nosologica. Ma i primi a descrivere la presenza in tali malati di una paralisi bulbare senza riscontro di alterazioni anatomiche furono Erb eGoldflam nella seconda metà del 1800 e per molti anni la malattia venne chiamata Sindrome di Erb e Goldflam. A coniare il termine Miastenia Gravis pseudoparalitica (per l’assenza di alterazioni anatomiche all’autopsia) fu invece Jolly nel 1895. Tale autore dimostrò che il deficit di forza miastenico del muscolo poteva essere riprodotto dalla stimolazione faradica ripetuta del nervo motore (ponendo così le basi di una delle tecniche strumentali di diagnosi della Miastenia ovvero la stimolazione ripetitiva del nervo messa a punto da Demstet). Nella prima metà del secolo scorso vennero messi a punto da Remen e Walker i primi farmaci attivi contro la malattia ovvero gli anticolinesterasici. Le alterazioni timiche nel corso di Miastenia Gravis furono descritte nel 1949 da Castleman e Norris. La natura autoimmune della malattia venne definita da Patrick, Lindstrom Fambrough, Lennon ed Engel nei primi anni settanta secolo scorso.
Epidemiologia
La Miastenia Gravis è da considerarsi una malattia rara con una incidenza di 4-5 per milione di abitanti e una prevalenza che a seconda delle casisitiche varia da 43 a 84 individui per milione di abitanti. La prevalenza della malattia appare però in aumento negli ultimi anni forse anche per migliore qualità diagnostica. Ha classicamente due picchi d’incidenza: età giovanile ( seconda terza decade di vita con netta prevalenza nel sesso femminile, rapporto 5:1) ed età anziana (sesta settima decade con prevalenza del sesso maschile, rapporto 3:1) più spesso associata a timoma.
Eziologia e patogenesi
 La patogenesi della Miastenia Gravis è da ricondursi ad un attacco autoimmune anticorpo-mediato che soddisfa i criteri di diagnosi di malattia autoanticorpo mediata (Drachman 1978) diretto contro il recettore dell’acetilcolina (Ach-R). Il Recettore dell’acetilcolina è una proteina transmembrana composta quattro subunità (2alfa, beta e gamma nell’adulto) la cui attivazione da parte dei quanti di aceticolina rilasciati dalla terminazione nervosa sinaptica determina l’attivazione di una cascata di eventi che porta alla contrazione muscolare. In genere l’anticorpo riconosce un epitopo sito sulla Main Immunogenic Region (MIR) dell’AchR e ciò determina il blocco, l’internalizzazione e la distruzione dello stesso recettore. Gli anticorpi diretti contro il recettore dell’acetetilcolina sono presenti in circa l’85% dei pazienti affetti dalla forma generalizzata e nel 50-60% dei pazienti con la forma esclusivamente oculare.
La patogenesi della Miastenia Gravis è da ricondursi ad un attacco autoimmune anticorpo-mediato che soddisfa i criteri di diagnosi di malattia autoanticorpo mediata (Drachman 1978) diretto contro il recettore dell’acetilcolina (Ach-R). Il Recettore dell’acetilcolina è una proteina transmembrana composta quattro subunità (2alfa, beta e gamma nell’adulto) la cui attivazione da parte dei quanti di aceticolina rilasciati dalla terminazione nervosa sinaptica determina l’attivazione di una cascata di eventi che porta alla contrazione muscolare. In genere l’anticorpo riconosce un epitopo sito sulla Main Immunogenic Region (MIR) dell’AchR e ciò determina il blocco, l’internalizzazione e la distruzione dello stesso recettore. Gli anticorpi diretti contro il recettore dell’acetetilcolina sono presenti in circa l’85% dei pazienti affetti dalla forma generalizzata e nel 50-60% dei pazienti con la forma esclusivamente oculare.
La trasmissione neuromuscolare può essere compromessa in diversi modi: 1) l’anticorpo può bloccare il legame tra acetilcolina e d il suo recettore, 2) si è dimostrato che le IgG sieriche dei pazienti miastenici sono in grado di incrementare il tasso di degradazione del recettore di due/tre volte e ciò può essere dato dalla capacità degli anticorpi di formare legami crociati con i recettori che vengono raggruppati sulla membrana muscolare e successivamente internalizzati tramite un processo di endocitosi e quindi degradati, 3) gli anticorpi possono causare una distruzione complemento-mediata delle superfici post-sinaptiche.
In alcune gravi forme di Miastenia (cosiddette oculo-bulbari) sieronegative è stata recentemente dimostrata la presenza di anticorpi anti MUSK una tirosin chinasi sita nella vicinanza del Ach-R (A. Vincent Nature Medicin 2001). Secondo i dati più recenti circa il 50% dei miastenici sieronegativi sarebbe anti MUSK positivo.
Anatomia patologica
Riguarda principalmente il Timo che è la sede dove vengono educati i linfociti T. Nel 10-15% dei pazienti si osserva una neoplasia della ghiandola. L’iperplasia timica e la persistenza dei follicoli linfoidi con centri germinativi attivi confinanti con la midollare del timo, sono presenti almeno nel 65 % dei pazienti specialmente quelli giovani. I follicoli sono caratterizzati dalla presenza di istiociti al loro centro circondati da linfociti T-helper, linfociti B e plasmacellule. Da segnalare che vi sono nel timo delle cellule di sostegno cosiddette mioidi che esprimono il recettore per l’acetilcolina. A livello della giunzione neuromuscolare solo la microscopia elettronica rivela una semplificazione della placca nel versante postsinaptico.
Diagnosi
La diagnosi di Miastenia Gravis rimane ancora principalmente clinica e tutt’ora, specialmente in alcune regioni italiane la malattia è sottodiagnosticata o la diagnosi viene posta con ritardo e questo per due motivi:
1 – I sintomi e segni specialmente all’esordio, essendo fluttuanti e potendo essere discreti possono non essere riconosciuti dal Medico Curante che non invia il paziente dallo specialista.
2 – E’ una malattia che si vede molto raramente.
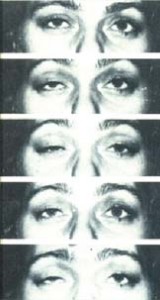
La caratteristica che si deve ricercare e che deve mettere in allarme è l’esauribilità, il paziente riferisce di visione sdoppiata dopo un po’ che legge, riduzione del tono della voce dopo lungo o breve colloquio con il riposo vi è recupero delle forze.
Vi sono comunque anche dei segni che aiutano ad ipotizzare la presenza clinica di una Miastenia Gravis; vi sono muscoli che possono rimanere sempre deboli anche in presenza di adeguata terapia anticolinesterasica ed immunosoppressiva. Ad esempio l’ipostenia della muscolatura flessoria del collo è considerato un hallmark della malattia spesso rimane ipostenia di grado variabile nelle prove contro resistenza dei muscoli orbicolaris oculi o della muscolatura addominale. Vi sono, però, delle prove di sensibilizzazione estremamente utili ad esempio se viene riferita ptosi palpebrale fluttuante non presente al momento dell’esame un test di provocazione consiste nel far guardate il paziente verso l’alto per almeno 30” un’altra prova potrebbero essere quella di far eseguire al paziente 15 piegamenti. E’ come sempre l’esperienza clinica che ci da le “dritte” per porre il sospetto di malattia o in presenza di negatività degli esami strumentali (e purtroppo quest’ultima evenienza non poi così infrequente) di porre una corretta diagnosi.
Da ricordare, infine, che la Miastenia Gravis si associa con frequenza che varia con le casistiche dal 2,3 al 24,2% (media 12’9%) ad altre malattie autoimmuna; la più frequente è la tiroidite con presenza di anticorpi anti tiroide, segue l’artrite reumatoide e meno frequentemente il LES e via via tutte le altre malattie sistemiche autoimmuni.
Esami strumentali
EMG con stimolazione ripetitiva: stimolazione sovramassimale a 3Hz di un nervo periferico e registrazione di un potenziale di unità motoria (CMAP) dal rispettivo muscolo utilizzando elettrodi di superficie. Il reperto tipico nella Miastenia Gravis è un decremento del CMAP con raggiungimento del minimo dell’ampiezza al quarto CMAP.Tale test viene sensibilizzato se è preceduto da esercizio muscolare di almeno 60” o da ischemia. L’assunzione di anticolinesterasici normalizza il test che comunque non è così frequentemente positivo anche in forme chiare e generalizzate di MG. L’EMG a singola fibra sembra più sensibile nel supportare la diagnosi della malattia ma è gravato da difficoltà di esecuzione dipendenti sia dall’esperienza del Neurofisiologo sia dalle capacità di comprensione e di collaborazione del paziente.
Più controversa ancora e ormai in disuso in molti centri è la prova all’edrofonio (Tensilon) tra l’altro non più disponibile in Italia. La prova consiste nell’iniettare prima 1 mg di Tensilon seguito a distanza di 45 “ da altri 3-6 mg dopo avere testato la forza di taluni muscoli cranici e valutando obiettivamente l’eventuale miglioramento della stenia degli stessi. Ricordarsi di tenere a disposizione dell’atropina per gli effetti muscarinici dell’edrofonio.
La presenza di anticorpi diretti contro il recettore dell’acetilcolina (ACh-R Ab) repertati con metodo radioimmunologico è un test sensibile ed altamente specifico. Il numero di sieropositivi varia a seconda delle casistiche. Newsom-Davis ed A. Vincent hanno riscontrato la presenza di ACh-R Ab nel 85-90% delle forme generalizzate di MG e nel 60% delle forme puramente oculari. Lo stesso gruppo ha recentemente scoperto quegli anticorpi anti MUSK di cui ho parlato nella patogenesi della MG.
In conclusione comunque si può dire che combinando i vari dati strumentali e di laboratorio si può arrivare ad una buona confidenza diagnostica.
Classificazione delle forme cliniche di miastenia: Osserman (1958) Modificato MGFA
TERAPIA
Presidi generali – Evitare quei farmaci che possono provocare debolezza miastenica o aumentarla (segue elenco) Ricordando comunque che la controindicazione è nella maggior parte dei casi solamente relativa.
Istruire il paziente e/o i famigliari sia sugli effetti collaterali dei farmaci antimiastenia sia su quei sintomi o segni miastenici che richiedono almeno un consulto con lo specialista ed a questo proposito fornire un recapito dove poter fare riferimento.
Ricordare al paziente che la malattia se ben seguita ha una prospettiva di vita normale, che le donne possono avere figli ( l’indebolimento in genere si presenta un mese dopo il parto) che vi può essere peggioramento della sintomatologia nella fase premestruale.
Insomma informare che è una malattia che deve essere ben conosciuta anche dal paziente stesso.
Anticolinesterasici – I primi ad essere impiegati, essi hanno drasticamente ridotto la mortalità per MG, la più usata è la piridostigmina (Mestinon), spesso risultano inefficaci nella diplopia delle forme puramente oculari di MG. La formulazione pronta ha una durata di circa 4 ore. Gli effetti collaterali sono quelli muscarinici. Attenzione il sovradosaggio da anticolinesterasici somiglia alla crisi miastenia, è ancora una volta la presenza degli effetti muscarinici (nausea, vomito, salivazione, pallore, sudorazione, coliche, bradicardia e miosi pupillare) che aiuta nella diagnosi differenziale.
 Immunoterapie a breve termine: – Hanno il pregio di agire sui sintomi e segni miastenici in breve tempo. Si tratta della Plasmaferesi e delle Immunoglobuline ad alte dosi. L’efficacia dei due trattamenti è risultata simile e si rivelano particolarmente utili nel trattare le “crisi miasteniche”, le esacerbazioni con segni “bulbari” della malattia. Il limite di tali trattamenti è la limitata durata nel tempo del beneficio clinico (durata media circa 20 giorni) motivo per il quale devono essere supportate da altri farmaci, in particolare lo steroide in grado di essere efficace in pochi giorni sul controllo dei sintomi e segni.
Immunoterapie a breve termine: – Hanno il pregio di agire sui sintomi e segni miastenici in breve tempo. Si tratta della Plasmaferesi e delle Immunoglobuline ad alte dosi. L’efficacia dei due trattamenti è risultata simile e si rivelano particolarmente utili nel trattare le “crisi miasteniche”, le esacerbazioni con segni “bulbari” della malattia. Il limite di tali trattamenti è la limitata durata nel tempo del beneficio clinico (durata media circa 20 giorni) motivo per il quale devono essere supportate da altri farmaci, in particolare lo steroide in grado di essere efficace in pochi giorni sul controllo dei sintomi e segni.
Alcuni autori utilizzano le immunoterapie a breve termine per stabilizzate i pazienti da un punto di vista sintomatologico per l’intervento di timectomia.
Cortisone (Prednisone) – Come già indicato è efficace in pochi giorni ma per motivi non ancora ben chiariti può dare un peggioramento clinico nei primi giorni di trattamento. Il dosaggio è quello immunosoppressivo cioè relativamente elevato, alcuni autori iniziano con bassi dosaggi per ridurre l’incidenza del deterioramento da inizio terapia ma non vi sono prove certe di questo ed altri autori iniziano subito con i dosaggi immunosoppressivi.
Il problema dello steroide sono gli effetti collaterali: aumento della P.A., della glicemia, depauperazione di potassio, rischio di miopatia da steroide, aumento del tono oculare e comparsa di cataratta, specie nelle donne dopo la menopausa osteoporosi, in più irsutismo acne e faccia a luna ,piena. Per tali motivi è buona regola passare a giorni alterni l’assunzione del farmaco ed arrivare alla dose minima efficace per tenere sotto controllo la sintomatologia.
Azatioprina – E’ un farmaco che se ben tollerato può in alcuni casi sostituire completamente lo steroide, mentre più spesso è usato in associazione per ridurne il dosaggio. Tra gli immunosoppressori dopo il Prednisone è considerato di prima scelta. Entra in funzione nel controllo clinico non prima di 5-6 mesi è in genere ben tollerato. Bisogna monitorare la funzionalità epatica e l’emocromo. Va interrotto per breve periodo in caso di infezione e se la conta dei G.B. arriva ad essere inferiore a 2500/mm^3.
Micofenolato – E’ attualmente considerato di seconda scelta in caso di non controllo od intolleranza ad azatioprina non vi sono ancora su di esso studi randomizzati in doppio cieco ma studi anedottici hanno evidenziato una efficacia simile all’azatioprina di cui condivide tempi di entrata in funzione ed effetti collaterali. Dosaggio 2 gr/die E’ un farmaco molto costoso e distribuito solo da alcuni centri.
Ciclosporina – Meno pazienti rispondono a questo farmaco che comunque nei responder si dimostra efficace già nel giro di qualche settimana. Dosaggio 6mg/Kg/die. Controindicazioni grave ipertensione arteriosa, nefropatia
Ciclofosfamide – Usato solo nelle gravi Miastenie che non rispondono agli altri immunosoppressori. Dosaggio 2,5-3 mg/Kg/die aggiustato per mantenere la conta dei G.B. tra 2500 e 4000 mm^3 e la percentuale dei linfociti sotto al 10%.
